Вал ала гли: Полипептид состоит из следующих аминокислот:
Обучающие задачи — Студопедия
Задача 1.Будет ли одинаковой интенсивность окраски, полученной в реакции с биуретовым реактивом, для растворов альбумина (Mr 64000 D) и иммуноглобулина G (Mr 175000D)одинаковой молярной концентрации? В чем заключается принцип биуретовой реакции?
Ответ.С биуретовым реактивом реагируют пептидные группы белков – образуется хелатный комплекс фиолетового цвета. Изменение окраски раствора при использовании биуретового реактива пропорционально не столько концентрации белка как таковой, сколько количеству пептидных связей. По сравнению с иммуноглобулинами, альбумин содержит меньше остатков аминокислот, так как имеет меньшую молекулярную массу, следовательно, интенсивность окраски раствора альбумина будет меньше при одинаковой молярной массе белков.
Задача 2.В ходе разделения смеси аминокислот хроматографическим методом подавляющее большинство протеиногенных аминокислот дают сине-фиолетовое окрашивание с нингидрином, а пролин и оксипролин – желтое.
Ответ.При нагревании в щелочной среде нингидрина с веществами, имеющими первичные аминогруппы (—NH2), образуется продукт, который имеет устойчивую интенсивную сине-фиолетовую окраску с максимальным поглощением около 570 нм. Нингидриновая реакция также используется для определения вторичных аминогрупп (>NH) в иминокислотах — пролине и оксипролине; в этом случае образуется продукт ярко-жёлтого цвета. Пролин и оксипролин являются иминокислотами, имеющими циклическую структуру, что влияет на структуру окрашенного комплекса с нингидрином и его светопоглощение.
оксипролин
При подготовке к занятию следует изучить обратимые и необратимые методы осаждения белков, их физико-химические свойства согласно таблице 2 и рисунку 3.
Таблица 2.Физико-химические свойства белков.
| Задание | Указания к выполнению задания |
1. Изучите суть явления растворимости и осаждаемости белков. Изучите суть явления растворимости и осаждаемости белков.
| 1. Какие физико-химические свойства белков обусловливают их растворимость? Чем обусловлена различная растворимость глобулярных и фибриллярных белков? Перечислите факторы, определяющие растворимость белков. 2. Приведите два основных фактора стабилизации белка в растворе. 4. В чем суть явления высаливания? 5. Приведите примеры практического использования высаливания. 6. Дайте определение явлению денатурации. Приведите классификацию видов денатурации. 7. Приведите примеры практического использования денатурации белков. |
| 2.Изучите явление появления заряда у белковых молекул. | 1.Выпишите два основных фактора, определяющих заряд белковой молекулы. 2.Напишите, что называется изоэлектрической точкой. Каковы свойства белков в изоэлектрическом состоянии? В какой среде будет находиться изоэлектрическая точка альбуминов и гистонов? |
БЕЛОК В РАСТВОРЕ СТАБИЛИЗИРУЮТ
2 ФАКТОРА – ЗАРЯД И ГИДРАТНАЯ ОБОЛОЧКА
МЕТОДЫ ОСАЖДЕНИЯ
ДЕГИДРАТАЦИЯ И НЕЙТРАЛИЗАЦИЯ ЗАРЯДА БЕЛКОВЫХ ЧАСТИЦ
НАРУШЕНИЕ ВТОРИЧНОЙ,
ТРЕТИЧНОЙ И ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
УТРАЧИВАЕТСЯ
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ СОХРАНЯЕТСЯ
Рисунок 3. Схема «Методы осаждения белка»
Схема «Методы осаждения белка»
Задания для самоконтроля
Выберите один наиболее правильный ответ.
1. ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА ПЕПТИДА ГЛИ-АЛА-ВАЛ НАХОДИТСЯ В ЗОНЕ рН
1) нейтральной
2) слабокислой
3) щелочной
2 В ЩЕЛОЧНОЙ СРЕДЕ (рН 10) ДАННЫЙ ПЕПТИД БУДЕТ ДВИГАТЬСЯ К
а) аноду
б) катоду
3. ПРЕРЫВАЕТ a-СПИРАЛИЗАЦИЮ ПОЛИПЕПТИДНОЙ ЦЕПИ
1) тирозин
2) триптофан
3) валин
4) пролин
5) аспарагин
4.НА ПОВЕРХНОСТИ ГЛОБУЛЯРНОГО БЕЛКА, РАСТВОРИМОГО В ВОДЕ, НАИМЕНЕЕ ВЕРОЯТНО РАСПОЛОЖЕНИЕ АМИНОКИСЛОТНЫХ ОСТАТКОВ
1) арг, глу
2) лиз, асп
3) вал, лей
5.НАКАПЛИВАЮЩИЙСЯ В ТКАНИ МОЗГА ПРИ БОЛЕЗНИ АЛЬЦМЕЙГЕРА β-АМИЛОИД ПРЕДСТАВЛЯЕТ СОБОЙ
1)продукт экспрессии мутантного гена
2)нормальный белок с измененной конформацией
3) глобулярный белок с высоким содержанием α-структур
4) нерастворимые фибриллы с β-складчатой структурой
6. НАИБОЛЕЕ ОПТИМАЛЬНЫЙ МЕТОД ОСАЖДЕНИЯ БЕЛКА С ЦЕЛЬЮ ДАЛЬНЕЙШЕГО ИСПОЛЬОВАНИЯ ЕГО БИОЛОГИЧЕСКОЙ АКТИВНОСТИ
НАИБОЛЕЕ ОПТИМАЛЬНЫЙ МЕТОД ОСАЖДЕНИЯ БЕЛКА С ЦЕЛЬЮ ДАЛЬНЕЙШЕГО ИСПОЛЬОВАНИЯ ЕГО БИОЛОГИЧЕСКОЙ АКТИВНОСТИ
1)осаждение органическими кислотами
2)осаждение гуанидинхлоридом
3)осаждение солями тяжелых металлов
4)высаливание
5)обработка парахлормеркурибензоатом или йодацетатом
7. ПРИ РАЗДЕЛЕНИИ БЕЛКОВ СЫВОРОТКИ КРОВИ ВЫСАЛИВАНИЕМ ОЧИСТИТЬ ИХ ОТ СУЛЬФАТА АММОНИЯ ПОЗВОЛЯЕТ
1) хроматография
2) спектроскопия
3) высушивание при 1000С
4) диализ
5)рефрактометрия
8.ПРИОНОВЫЕ БЕЛКИ
1)способствуют поддержанию нативной конформации белка
2)нарушают нативную конформацию белка, приводя к образованию функционально неактивных агрегатов
3)легко гидролизуются протеолитическими ферментами
4)устойчивы к действию протеаз
5)участвуют в фолдинге белков
Общие свойства аминокислот. «БИОЛОГИЧЕСКАЯ ХИМИЯ», Березов Т.Т., Коровкин Б.Ф.
 Эти свойства аминокислот определяют многие
физико-химические и биологические свойства белков. На этих свойствах основаны,
кроме того, почти все методы выделения и идентификации аминокислот.
Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных
растворов в форме биполярных (амфотерных) ионов (цвиттерионов), а не в виде
недиссоциированных молекул (последнюю структуру приводят для удобства представления,
однако все аминокислоты при физиологических значениях рН имеют структуру
цвиттериона).
Эти свойства аминокислот определяют многие
физико-химические и биологические свойства белков. На этих свойствах основаны,
кроме того, почти все методы выделения и идентификации аминокислот.
Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных
растворов в форме биполярных (амфотерных) ионов (цвиттерионов), а не в виде
недиссоциированных молекул (последнюю структуру приводят для удобства представления,
однако все аминокислоты при физиологических значениях рН имеют структуру
цвиттериона).При растворении в воде кристаллическая аминокислота, например аланин, может реагировать или как кислота (донатор протона):
или как основание (акцептор протона):
Если радикалы
аминокислот нейтральные, то они почти не оказывают влияния на диссоциацию
α-карбоксильной группы или α-аминогруппы, и величины рК
(отрицательный логарифм константы диссоциации) остаются относительно
постоянными. Вследствие этого кривые диссоциации почти всех нейтральных
аминокислот накладываются друг на друга и могут быть рассмотрены на примере
аланина. Если к раствору аланина (например, 0,1 М) в воде постепенно прибавлять
сильную кислоту (0,1 М раствор НСl) или сильную щелочь (0,1 М раствор NaOH),
то получим кривую титрования аланина, типичную для всех нейтральных
аминокислот (рис. 1.6).
Вследствие этого кривые диссоциации почти всех нейтральных
аминокислот накладываются друг на друга и могут быть рассмотрены на примере
аланина. Если к раствору аланина (например, 0,1 М) в воде постепенно прибавлять
сильную кислоту (0,1 М раствор НСl) или сильную щелочь (0,1 М раствор NaOH),
то получим кривую титрования аланина, типичную для всех нейтральных
аминокислот (рис. 1.6).
Кажущиеся
величины рК’ для α-карбоксильной группы и α-аминогрупп (т.е. значения
рН, при которых эти группы в среднем наполовину диссоциированы) довольно сильно
различаются, составляя pK1 = 2,34 и рК2
= 9,69. При низком значении рН (ниже pK1‘) почти все
молекулы аланина являются полностью протонированными и несут положительный
заряд. Другими словами, при высокой концентрации водородных ионов в растворе
тенденция к диссоциации водорода из структуры аланина оказывается
незначительной. Из кривой титрования видно, что точка перехода между ветвями
кривой располагается при рН 6,02.
Это означает, что при данном значении рН суммарный (или средний) электрический заряд молекулы аланина равен нулю и она не перемещается в электрическом поле ни к аноду, ни к катоду (изоэлектрическое состояние). Такое значение рН получило название изоэлектрической точки и обозначается pI. Изоэлектрическая точка аминокислот, не содержащих дополнительных NH2— или СООН-групп, представляет собой среднее арифметическое между двумя значениями рК’:
соответственно для аланина
Изоэлектрическая
точка ряда других аминокислот, содержащих дополнительные кислотные или основные
группы (аспарагиновая и глутаминовая кислоты, лизин, аргинин, тирозин и др.),
зависит, кроме того, от кислотности или основности радикалов этих аминокислот.
Для лизина, например, рI должна вычисляться из полусуммы значений рК’ для α- и
ε-NН2-групп. Таким образом, в интервале рН от 4,0 до 9,0 почти
все аминокислоты существуют преимущественно в форме цвиттерионов с
протонированной аминогруппой и диссоциированной карбоксильной группой.
Рис. 1.6. Кривые, полученные при титровании 0,1 М раствора аланина 0,1 М раствором НСl (а) и 0,1 М раствором NaOH (б).
Стереохимия аминокислот. Важнейшим свойством аминокислот,
освобождающихся в процессе гидролиза природных белков в условиях, исключающих
рацемизацию, является их оптическая активность. Будучи растворенными в воде
(или в НСl), они способны вращать плоскость поляризованного луча (исключение
составляет глицин). Это свойство связано с наличием в молекуле всех природных
аминокислот (за ислючением глицина) в α-положении
асимметрического атома углерода (т. е. атома углерода, все четыре валентные
связи которого заняты различными заместителями). Величины удельного вращения
вправо или влево являются количественной характеристикой оптической активности,
и для большинства аминокислот [а]2р составляет от 10 до 30°.
Примерно половина аминокислот белков оказалась правовращающей, их обозначают
знаком «+» (Ала, Иле, Глу, Лиз и др.), а чуть меньше половины — левовращающей
(Фен, Трп, Лей и др.), их обозначают знаком «–». Все эти аминокислоты
принадлежат к L-ряду, а величина
и знак оптического вращения зависят от природы радикалов аминокислот и значения
рН раствора, в котором измеряют оптическое вращение.
Величины удельного вращения
вправо или влево являются количественной характеристикой оптической активности,
и для большинства аминокислот [а]2р составляет от 10 до 30°.
Примерно половина аминокислот белков оказалась правовращающей, их обозначают
знаком «+» (Ала, Иле, Глу, Лиз и др.), а чуть меньше половины — левовращающей
(Фен, Трп, Лей и др.), их обозначают знаком «–». Все эти аминокислоты
принадлежат к L-ряду, а величина
и знак оптического вращения зависят от природы радикалов аминокислот и значения
рН раствора, в котором измеряют оптическое вращение.
Стереохимию
аминокислот принято оценивать не по оптическому вращению, а исходя из
абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг
асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную
конфигурацию аминокислот принято соотносить стереохимически с соединением,
произвольно взятым для сравнения, а именно с глицериновым альдегидом, также
содержащим асимметрический атом углерода. Ниже представлены L- и D-стереоизомеры
глицеринового альдегида. Рядом показаны пространственные конфигурации L-и D-аланина:
Ниже представлены L- и D-стереоизомеры
глицеринового альдегида. Рядом показаны пространственные конфигурации L-и D-аланина:
Все
аминокислоты, образующиеся при гидролизе природных белков в условиях,
исключающих рацемизацию, принадлежит к L-ряду. Таким образом,
природные аминокислоты имеют пространственное расположение, аналогичное
конфигурации L-глицеринового альдегида. Следует еще раз подчеркнуть, что
символы L и D означают принадлежность данной аминокислоты
по своей стереохимической конфигурации к L- или D-ряду, в то время как знак «+»
или «–» указывает на направление изменения плоскости поляризации светового
луча. Среди белковых аминокислот имеются две аминокислоты (треонин и
изолейцин), которые содержат по два асимметрических атома углерода.
Следовательно, если не в природе, то, во всяком случае, в лаборатории возможно
получить четыре стереоизомерные формы этих аминокислот . Для треонина
известны все четыре изомера. Если условно обозначить символом L выделенный из
природных белков треонин, то его зеркальное отображение называют D-треонином.
Два других изомера, получивших наименование диастереоизомеров, или аллоформ,
также могут иметь L- и D-формы. Структурные конфигурации всех четырех стереоизомеров
треонина можно представить следующими формулами:
Если условно обозначить символом L выделенный из
природных белков треонин, то его зеркальное отображение называют D-треонином.
Два других изомера, получивших наименование диастереоизомеров, или аллоформ,
также могут иметь L- и D-формы. Структурные конфигурации всех четырех стереоизомеров
треонина можно представить следующими формулами:
Как отмечалось, в белковой молекуле D-аминокислоты не обнаружены , однако в живой природе они широко распространены.
Так, D-изомеры глутаминовой кислоты, аланина, валина, фенилаланина, лейцина и ряда других открыты в клеточной стенке бактерий; в составе некоторых антибиотиков, в частности актиномицинов, бацитрацина, грамицидинов А и S, содержатся аминокислоты D-конфигурации.
Аминокислотный состав (качественный и количественный) многих тысяч белков, полученных из разных источников, выяснен (табл. 1.4).
При анализе
данных табл. 1.4 виден ряд закономерностей. На долю дикарбоновых аминокислот и
их амидов в большинстве белков приходится до 25–27% всех аминокислот. Эти же
аминокислоты вместе с лейцином и лизином составляют около 50% всех аминокислот.
В то же время на долю таких аминокислот, как цистеин, метионин, триптофан,
гистидин, приходится не более 1,5–3,5%. В протаминах и гистонах отмечено
высокое содержание основных аминокислот аргинина и лизина, соответственно 26,4
и 85,2% (см. «Химия простых белков»).
На долю дикарбоновых аминокислот и
их амидов в большинстве белков приходится до 25–27% всех аминокислот. Эти же
аминокислоты вместе с лейцином и лизином составляют около 50% всех аминокислот.
В то же время на долю таких аминокислот, как цистеин, метионин, триптофан,
гистидин, приходится не более 1,5–3,5%. В протаминах и гистонах отмечено
высокое содержание основных аминокислот аргинина и лизина, соответственно 26,4
и 85,2% (см. «Химия простых белков»).
Химические реакции для открытия и определения аминокислот в гидролизатах
белков. В курсе
органической химии подробно рассмотрено множество химических реакций,
характерных для α-амино- и α-карбоксильных групп аминокислот
(ацилирование, алкилирование, нитрование, этерификация и др.). Здесь
будут рассмотрены общие цветные реакции для обнаружения индивидуальных
аминокислот и аминокислот, входящих в состав белков, основанные на химической
природе радикалов аминокислот (табл. 1.5).
1.5).
Для открытия в биообъектах и количественного определения аминокислот успешно применяется реакция их с нингидрином. На I стадии реакции образуется восстановленный нингидрин за счет окислительного дезаминирования аминокислот (параллельно происходит декарбоксилирование аминокислот):
На II стадии образовавшийся аммиак реагирует с эквимолярными количествами окисленного и восстановленного нингидрина, образуя сине-фиолетовый продукт, интенсивность окраски которого (при 570 нм) пропорциональна количеству аминокислоты:
На основе
нингидриновой реакции были разработаны методы количественного определения
аминокислот, в частности метод распределительной хроматографии на бумаге,
впервые внедренный в 1944 г. (А. Мартин и Р. Синдж). Эта же реакция
используется благодаря своей высокой чувствительности в автоматическом
анализаторе аминокислот. Впервые такой прибор сконструировали Д. Шпакман, С. Мур и У. Стейн (рис. 1.7). После разделения смеси аминокислот в колонках,
заполненных специальными ионообменными смолами (сульфополистирольный катионит),
ток элюента из колонки поступает в смеситель, туда же поступает раствор
нингидрина; интенсивность образующейся окраски автоматически измеряется на
фотоэлектроколориметре и регистрируется самописцем. Этот метод нашел широкое
применение в клинической практике при исследовании крови, мочи, спинномозговой
жидкости. С его помощью за 2–3 ч можно получить полную картину качественного
состава аминокислот в биологических
жидкостях и выявить наличие в них необычных азотсодержащих веществ, что имеет
важное диагностическое и прогностическое значение.
Мур и У. Стейн (рис. 1.7). После разделения смеси аминокислот в колонках,
заполненных специальными ионообменными смолами (сульфополистирольный катионит),
ток элюента из колонки поступает в смеситель, туда же поступает раствор
нингидрина; интенсивность образующейся окраски автоматически измеряется на
фотоэлектроколориметре и регистрируется самописцем. Этот метод нашел широкое
применение в клинической практике при исследовании крови, мочи, спинномозговой
жидкости. С его помощью за 2–3 ч можно получить полную картину качественного
состава аминокислот в биологических
жидкостях и выявить наличие в них необычных азотсодержащих веществ, что имеет
важное диагностическое и прогностическое значение.
Рис. 1.7. Работа автоматического анализатора аминокислот (принципиальная схема
по Шпакману, Муру и Стейну).
1 — смеситель; 2 — фотоэлектроколориметр; 3 — самописец.
Автоматические
анализаторы аминокислот все время совершенствуются, повышаются чувствительность
методов и скорость проведения анализа. Так, в современных приборах
высокоэффективной жидкостной хроматографии (ВЭЖХ) удается проводить анализ
гидролизата белка за 45 мин, определяя при этом концентрацию аминокислот в
пикомолях (рис. 1.8).
Так, в современных приборах
высокоэффективной жидкостной хроматографии (ВЭЖХ) удается проводить анализ
гидролизата белка за 45 мин, определяя при этом концентрацию аминокислот в
пикомолях (рис. 1.8).
Смесь аминокислот может быть успешно разделена также методом электрофореза на бумаге. При рН 6,0 возможно хорошее разделение кислых и основных аминокислот с нейтральными. В этом случае отрицательно заряженные (кислые) аминокислоты будут двигаться к аноду, а положительно заряженные – к катоду. Нейтральные аминокислоты остаются на линии старта.
Для их разделения электрофорез обычно проводят при рН 1,8–2,0, когда все они мигрируют к аноду с незначительным, но уловимым различием в подвижности. После электрофореза местоположение аминокислот на электофореграмме выявляют с помощью химических реакций, а после элюции окрашенных продуктов определяют их количественно.
Рис. 1.8. ВЭЖХ
аминокислот по Цеху и Вольтеру. Разделение на колонке (3 х 250 мм), наполненной
ионообменной смолой – полистиролдивинилбензолом. Концентрация аминокислот 500
пмоль/л, реактив для детектирования – флюорескамин, образующий с аминогруппой
сильно флюоресцирующее соединение.
Разделение на колонке (3 х 250 мм), наполненной
ионообменной смолой – полистиролдивинилбензолом. Концентрация аминокислот 500
пмоль/л, реактив для детектирования – флюорескамин, образующий с аминогруппой
сильно флюоресцирующее соединение.
1 — Асп; 2 - Тре; 3 — Сер; 4 — Глу; 5 — Гли; 6 — Ала; 7 — Цис; 8 — Вал; 9 — Мет; 10 -Иле; 11 — Лей; 12 — Тир; 13 — Фен; 14 -Лиз; 15 — Гис; 16 — Арг.
Предыдущая страница | Следующая страница
СОДЕРЖАНИЕ
Подберите к каждой аминокислоте соответствующее свойство радикала.
⇐ ПредыдущаяСтр 3 из 15Следующая ⇒А. Фен
Б. Глу
В. Цис
Г. Арг
Д. Сер
1. Гидрофильный с анионной группой
2. Гидрофильный с катионной группой
3. Гидрофобный
ответ: 1-Б 2-Г 3-А
Выберите один правильный ответ.
Присутствие любого белка в растворе можно определить с помощью реакции:
А. Биуретовой
Биуретовой
Б. Ксантопротеиновой
В. Нингидриновой
Г. С фенилизотиоцианатом
Д. Фоля
54. Выберите правильные ответы. Цветные реакции позволяют судить о:
А. Присутствии белков в биологических жидкостях
Б. Первичной структуре белков
В. Присутствии некоторых аминокислот в белке
Г. Количестве аминокислот в белке
Д. Функции белков
55. Выберите один правильный ответ. Пептид, на С-конце которого находится иминокислота:
А. Вал — Иле — Сер — Тре
Б. Цис — Ала — Про – Тир
В. Про — Гис — Гли — Три
Г. Мет — Глу — Лиз — Фен
Д. Иле — Три — Сер — Про
Выберите один правильный ответ. Пептид, на N-конце которого находится диаминомонокарбо-
новая кислота:
А. Тре — Ала — Лиз — Про
Тре — Ала — Лиз — Про
Б. Лиз — Сер — Гис — Глн
В. Асн — Вал — Иле — Арг
Г. Глу — Лей — Тре — Лиз
Д. Три — Мет — Гли — Глн
Выберите один правильный ответ.
Для количественного определенияаминокислот в растворе используют:
А. Биуретовый метод
Б. Реакцию Фоля
В. Ксантопротеиновую реакцию
Г. Реакцию с нингидрином
Д. Реакцию Сакагути
58. Выберите один неправильный ответ. Радикалы аминокислот могут образовывать водородные связи:
А. Тре
Б. Арг
В. Гис
Г. Три
Д. Асп
59. Выберите один правильный ответ. Фенилизотиоцианат используется для определения:
А. Количества белка в растворе
Б. Присутствия циклических аминокислот
В. С-концевой аминокислоты
С-концевой аминокислоты
Г. N-концевой аминокислоты
Д. Количества аминокислот в белке
Установите соответствие.
А.Первичная структура
Б Первичная структура
В. Третичная структура
Г. Супервторичная структура
Д. Конформация
1. Стабилизируется водородными связями между атомами пептидного остова
2. В ее формировании принимают участие гидрофобные взаимодействия радикалов аминокислот
3.Фиксируется ковалентными связями между а-амино- и а-карбоксильными группами аминокислот
ответ 1-Б 2-В 3-А
Выберите один неправильный ответ.
Водородные связи могут образовываться между радикалами аминокислот:
А. Сер, Глн
Б. Три, Асп
В. Тре, Лиз
Г.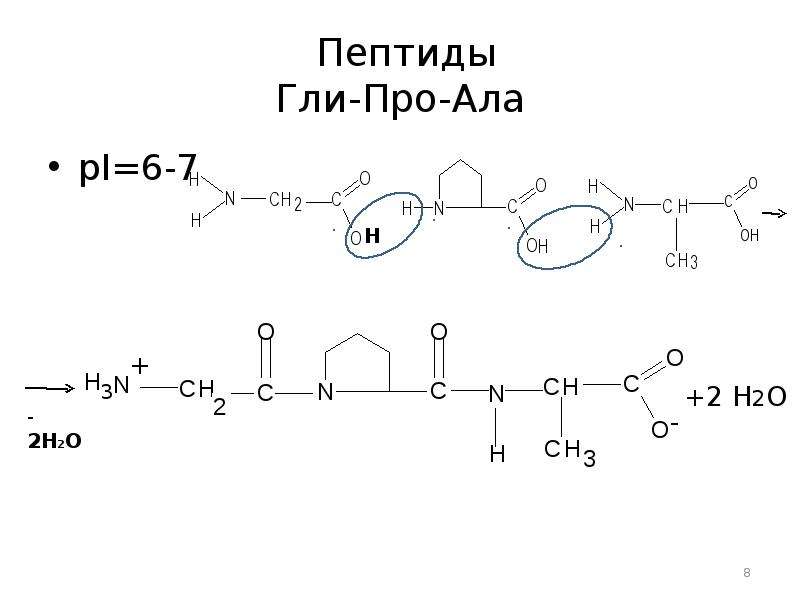 Глу, Цис
Глу, Цис
Д. Асп, Сер
Выберите один неправильный ответ.
Гидрофобные связи могут образовываться между радикалами аминокислот:
А. Лей, Мет
Б. Три, Иле
В. Ала, Тре
Г. Вал, Фен
Д. Мет, Про
63. Выберите один неправильный ответ. К слабым связям, участвующим в образовании нативных белков, относятся:
А. Пептидные
Б. Водородные
В. Гидрофобные
Г. Ионные
Д. Ван-дер-ваальсовы взаимодействия
64. Выберите один правильный ответ. Водородные связи образуются между радикалами аминокислот:
А. Сер, Асн
Б, Ала, Вал
В. Глу, Асп
Г. Цис, Три
Д. Асп, Арг
Установите соответствие.
1. Аминокислота, образующаяионнуюсвязь с Асп
2. Аминокислота, располагающаяся внутри цитозольного глобулярного белка
Аминокислота, располагающаяся внутри цитозольного глобулярного белка
3. Аминокислота, не имеющая радикала
А. Асн
Б. Гли
В. Ала
Г. Глу
Д. Лиз
Ответ:1-д 2-в 3-б
66. Выберите один неправильный ответ. Гидрофобные радикалы аминокислот чаще всего располагаются:
А. Внутри глобулярных цитозольных белков
Б. В местах контактов протомеров олигомерных белков
В. На поверхности цитозольных белков
Г. На поверхности интегральных мембранных белков
Д. В активном центре белков
Выберите один наиболее полный ответ.
В белках водородные, ионные и гидрофобные связи участвуют в формировании:
А. Вторичной структуры
Б. Третичной структуры
В. Супервторичной структуры
Г. Первичной структуры
Первичной структуры
Д. Конформации
68. Выберите одно наиболее полное утверждение. В формировании конформации белка принимают участие преимущественно связи:
А. Водородные
Б. Гидрофобные
В. Ионные
Г. Слабые
Д. Межрадикальные
Установите соответствие.
А. Первичная структура
Б. Вторичная структура
В. Третичная структура
Г. Супервторичная структура
Д. Четвертичная структура
1. Порядок чередования аминокислот, соединенных пептидной связью
2. Пространственная структура, образованная водородными связями, возникающими между атомами пептидного остова
3. Специфический порядок чередования вторичных структур
1-А 2-Б 3-Г
70. Выберите правильные ответы. Олигомерный белок:
А. Состоит из нескольких протомеров
Состоит из нескольких протомеров
Б. Имеет полипептидные цепи, связанные дисульфид-ными связями
В. Содержит контактные поверхности протомеров, комплементарные друг другу
Г. Может связывать только один лиганд
Д. Формирует четвертичную структуру путем самосборки
71. Выберите один неправильный ответ. Шапероны:
А. Являются глобулярными белками
Б. Связываются с частично денатурированными белками
В. Облегчают разрушение частично денатурированных белков
Г. Находятся во всех отделах клетки
Д. Их синтез усиливается при стрессовых воздействиях
72. Выберите одно наиболее полное утверждение. Самосборка протомеров в олигомерный белок происходит благодаря наличию:
А. Гидрофобных радикалов в местах контакта
Б. Противоположно заряженных функциональных групп
Противоположно заряженных функциональных групп
В. Ионов металлов
Г. Комплементарности контактных поверхностей
Д. Ферментов, облегчающих взаимодействие контактирующих участков
73. Выберите правильные ответы. Комплементарностью молекул обусловлены взаимодействия:
А. Белка с лигандом
Б. Протомеров в олигомерном белке
В. Белка с диполями воды в растворе
Г. Различных белков в процессе самосборки клеточных органелл
Д. Радикалов аминокислот при формировании третичной структуры белка
74. Выберите одно наиболее полное определение. Конформация белка:
А. Аминокислотная последовательность полипептидной цепи
Б. Число полипептидных цепей в олигомерном белке
В. Укладка a-спиралей и b-структур в полипептидной цепи
Г. Характерное строение супервторичной структуры
Д. Пространственная структура белка
75. Выберите правильные ответы. Лигандом для белка может быть:
А. Ион металла
Б. Простетическая группа
В. Другой белок
Г. Органическая небелковая молекула
Д. Лекарственное вещество
76. Выберите один неправильный ответ. Активный центр белка:
А. Расположен в углублении белковой молекулы
Б. Является фрагментом полипептидной цепи
В. Сформирован радикалами аминокислот, находящихся на расстоянии друг от друга
Г. Имеет неровный рельеф
Д. Способен комплементарно связывать специфические лиганды
77. Выберите одно наиболее полное утверждение. Активный центр белка — это участок:
А. Комплементарно взаимодействующий с лигандом
Б. Находящийся в углублении белковой молекулы
В. Расположенный на поверхности белка и образованный радикалами аминокислот
Г. Сформированный на уровне третичной структуры
Д. Находящийся между двумя доменами
78. Выберите одно наиболее полное утверждение. Простетическая группа:
А. Неорганическая часть белка
Б. Органическая часть белка
В Присоединенное к белку лекарственное вещество
Г. Лиганд, присоединяемый к белку при функционировании
Д. Небелковая часть, прочно связанная с активным центром белка
Выберите один неправильный ответ.
Гем:
А. Небелковая часть гемосодержащих белков
Б. Состоит из 4 пиррольных колец
В. Обратимо связан с белковой частью гемоглобина
Г. Имеет в составе атом железа
Д. Входит в состав миоглобина
80. Выберите один неправильный ответ. Сродство гемоглобина к кислороду уменьшается:
А. По мере присоединения молекул02 к протомерам
гемоглобина
Б. При увеличении в крови концентрации СО2
В. В результате протонирования гемоглобина
Г. По мере отщепления 02 от протомеров гемоглобина
Д. При присоединении 2,3-бисфосфоглицерата
Установите соответствие.
1. Мономерный белок
2. Гемопротеин
3. Аллостерический белок
4. Фермент
А. Миоглобин Б. Гемоглобин В. Оба Г.Ни один
Ответ:1-а 2-в 3-б 4-г
Выберите один неправильный ответ.
Центр связывания белковой части миоглобина и гемоглобина с гемом:
А. Находится в углублении между двумя a-спиралями
Б. Образован преимущественно гидрофобными радикалами аминокислот
В. Удерживает гем за счет множества водородных и ионных связей
Г. Содержит 2 функционально важных остатка Гис
Д. Снижает сродство белков к оксиду углерода
83. Выберите один правильный ответ. Миоглобин и гемоглобин:
А. Олигомерные белки
Б. Гемопротеины
В. Фосфопротеины
Г. Взаимодействуют с 2,3-бисфосфоглицератом
Д. Белки эритроцитов
Установите соответствие.
А. Гистидин Е7
Б. Гистидин F8 В. Оба Г. Ни один
1. Находится в активном центре миоглобина и гемоглобина
2. Связан координационной связью с железом гема
3. Уменьшает сродство оксида углерода к железу гема
4. Связывается с 02
ответ 1-В 2-Б 3-А 4-Г
85. Выберите один неправильный ответ. 2,3-Бисфосфоглицерат:
А. Синтезируется вэритроцитах
Б. Содержится в клетке в одинаковых концентрациях с гемоглобином
В. Присоединяется к аллостерическому центру оксиге-моглобина [НЬ(02)4]
Г. Уменьшает сродство гемоглобина (НЬ) к 02
Д. Взаимодействует с радикалами аминокислот ионными связями
Установите соответствие.
1. Не взаимодействует с 2,3-бисфосфоглицератом
2. Преобладает в эритроцитах взрослого человека
3. Участвует в переносе О2
4. Содержит в составе 2a- и 2d-цепи
А. HbA Б. HbF В. Оба Г. Ни один
Ответ 1-б 2-а 3-в 4-г
Установите соответствие.
Читайте также:
Методическая разработка по биологии (10 класс): Как пользоваться таблицей генетического кода
Слайд 1
Как пользоваться таблицей генетического кода 05.11.2019 © Тихонова Е.Н.Слайд 2
Первое основание Второе основание Третье основание У Ц А Г У Фен Фен Лей Лей Сер Сер Сер Сер Тир Тир — — Цис Цис — Три У Ц А Г Ц Лей Лей Лей Лей Про Про Про Про Гис Гис Глн Глн Арг Арг Арг Арг У Ц А Г А Иле Иле Иле Мет Тре Тре Тре Тре Асн Асн Лиз Лиз Сер Сер Арг Арг У Ц А Г Г Вал Вал Вал Вал Ала Ала Ала Ала Асн Асн Глу Глу Гли Гли Гли Гли У Ц А Г Таблица генетического кода ( и-РНК )
Слайд 3
С помощью таблицы генетического кода определите какая аминокислота закодирована кодоном (триплетом) АГГ
Слайд 4
Первое основание Второе основание Третье основание У Ц А Г У Фен Фен Лей Лей Сер Сер Сер Сер Тир Тир — — Цис Цис — Три У Ц А Г Ц Лей Лей Лей Лей Про Про Про Про Гис Гис Глн Глн Арг Арг Арг Арг У Ц А Г А Иле Иле Иле Мет Тре Тре Тре Тре Асн Асн Лиз Лиз Сер Сер Арг Арг У Ц А Г Г Вал Вал Вал Вал Ала Ала Ала Ала Асн Асн Глу Глу Гли Гли Гли Гли У Ц А Г Таблица генетического кода ( и-РНК )
Слайд 5
Первое основание Второе основание Третье основание У Ц А Г У Фен Фен Лей Лей Сер Сер Сер Сер Тир Тир — — Цис Цис — Три У Ц А Г Ц Лей Лей Лей Лей Про Про Про Про Гис Гис Глн Глн Арг Арг Арг Арг У Ц А Г А Иле Иле Иле Мет Тре Тре Тре Тре Асн Асн Лиз Лиз Сер Сер Арг Арг У Ц А Г Г Вал Вал Вал Вал Ала Ала Ала Ала Асн Асн Глу Глу Гли Гли Гли Гли У Ц А Г
Слайд 6
Первое основание Второе основание Третье основание У Ц А Г У Фен Фен Лей Лей Сер Сер Сер Сер Тир Тир — — Цис Цис — Три У Ц А Г Ц Лей Лей Лей Лей Про Про Про Про Гис Гис Глн Глн Арг Арг Арг Арг У Ц А Г А Иле Иле Иле Мет Тре Тре Тре Тре Асн Асн Лиз Лиз Сер Сер Арг Арг У Ц А Г Г Вал Вал Вал Вал Ала Ала Ала Ала Асн Асн Глу Глу Гли Гли Гли Гли У Ц А Г
Слайд 7
Кодон и-РНК : АГГ Аминокислота: АРГ (аргинин)
Слайд 8
С помощью таблицы генетического кода определите какая аминокислота закодирована кодоном (триплетом) УГГ
Слайд 9
Первое основание Второе основание Третье основание У Ц А Г У Фен Фен Лей Лей Сер Сер Сер Сер Тир Тир — — Цис Цис — Три У Ц А Г Ц Лей Лей Лей Лей Про Про Про Про Гис Гис Глн Глн Арг Арг Арг Арг У Ц А Г А Иле Иле Иле Мет Тре Тре Тре Тре Асн Асн Лиз Лиз Сер Сер Арг Арг У Ц А Г Г Вал Вал Вал Вал Ала Ала Ала Ала Асн Асн Глу Глу Гли Гли Гли Гли У Ц А Г Таблица генетического кода ( и-РНК ) ТРИ
Слайд 10
С помощью таблицы генетического кода определите какая аминокислота закодирована кодоном (триплетом) ГЦА
Слайд 11
Первое основание Второе основание Третье основание У Ц А Г У Фен Фен Лей Лей Сер Сер Сер Сер Тир Тир — — Цис Цис — Три У Ц А Г Ц Лей Лей Лей Лей Про Про Про Про Гис Гис Глн Глн Арг Арг Арг Арг У Ц А Г А Иле Иле Иле Мет Тре Тре Тре Тре Асн Асн Лиз Лиз Сер Сер Арг Арг У Ц А Г Г Вал Вал Вал Вал Ала Ала Ала Ала Асн Асн Глу Глу Гли Гли Гли Гли У Ц А Г Таблица генетического кода ( и-РНК ) АЛА
|
|
Ала-Тир — Большая химическая энциклопедия
Было несложно идентифицировать спиновые системы из четырех валинов, пяти треонинов, четырех аланинов, трех глицинов, двух глутаматов и остатков типа AMX (Asp, Cys, Phe, Tyr, Trp и Ser) этого белка из COSY, RELAY , спектры NOESY в растворе DO.Спектр RELAY был особенно полезен для идентификации спиновых систем Val, Ala, Thr и Glu. [Стр.298]Устойчивость ВИЧ-1 к ННИОТ быстро возникает после пассажа вируса в культуре клеток в присутствии соединений. Мутация 181 Tyr-Cys встречается чаще всего, и она приводит к устойчивости или, по крайней мере, к снижению чувствительности к большинству ННИОТ (например, TIBO, HEPT, невирапин, пиридинон, BHAP, TSAO, a-APA) [78 -84]. Мутация 188 Tyr -> His связана с устойчивостью к TIBO [85], но не с невирапином [82]. Мутация 103 Lys -> Asn связана в основном с устойчивостью к TIBO и пиридинону [78,85], Мутация 100 Leu -> lie связана в основном с устойчивостью к TIBO [85,86].Мутация 106 Val -> Ala в основном приводит к устойчивости к невирапину и HEPT [83,84,87]. Мутация 138 Glu-Lys ответственна за устойчивость к TSAO [88,89]. Мутация 190 Gly-Glu объясняет устойчивость к хиноксалину [68], а также приводит к резкому снижению активности ОТ [90], а мутация 236 Pro-Leu отвечает за устойчивость к BHAP [91]. [Стр.327]
| Рис. 6.28. Реакции разрушения Val-Tyr-Xaa3-Asp-Xaa5-Ala в зависимости от pH (Asu = аспарагиновый сукцинимид) [93] [96], а) Реакции разрушения Val-Tyr-Pro-Asp-Gly-Ala при pH диапазоны 1-3, 4-5 и 6-10.б) Реакции разрушения Val-Tyr-Pro-Asp-Ser-Ala, Val-Tyr-Pro-Asp-Val-Ala и Val-Tyr-Gly-Asp-Gly-Ala при pH 1. в) Реакции разрушения то же … |
В следующих статьях описаны некоторые молекулярные и физические свойства этого фермента [EC 3.4.22.3], который катализирует гидролиз пептидных связей и проявляет широкую специфичность (по Lys-, Ala-, Tyr-, Gly-, Asn-, Leu- и Val-). [Стр.281]
Fio. 38. График алгоритма коэффициента удерживания k и log P, коэффициента распределения вода / i> октанол для восьми аминокислот. Хроматографические данные были получены на LiChrosorb kP-8 3 футм, внутренний диаметр 230 x 4,6 мм. eluierit 0,1 М водный фосфатный буфер, pH 6,7, T 70 C. Eluites Trp, триптофан Phe, фенилаланин Leu, лейдне Val. валин Tyr, тирозин Lys, лизин Ala, аланин Gly, глицин.Перепечатано с разрешения Молнара и Хорвита QOS). [Pg.140]
Turismo nelle Valli di Lanzo | Passeggiate
Con questa sezione vogliamo porre un igno tra l’escursionismo anche meno impegnativo e una serie di itinerari atti a fare scoprire il territorio sotto diversi aspetti, non solo naturalistici ma anche культурные piuttosto che. Troverete percorsi senza grandi dislivelli accessibili ed idonei a tutti.
Ci sono due percorsi «Sport e Natura», nella Val d’Ala e nella Val Grande, che, con uno sviluppo di oltre dieci chilometriungo i bordi della Stura, коллеги и различные варианты рендеринга, возможно, il rientro alla partenza con i mezzi pubblici Эти non si vuole percorrere ritroso il percorso.
Per una proposta di turismo culturale, ad Ala di Stura, «Paese delle Meridiane e degli Affreschi», troverete sette itinerari, che si sviluppano, привлекает различные виды путешествий, которые могут быть рендендио возможны для временного пребывания, alla scoperta an tera, quinente de sensologia есистева. Qui troverete una delle maggiori concentrazioni di orologi solari d’Europa, ben 76, insieme ad affreschi ed incisioni rupestri.
Esistono inoltre dei percorsi tematici for far scoprire agli interessati l’evoluzione dell’architettura locale в seguito all’avvento del turismo nelle nostre valli a partire da штраф ‘800.Potrete quindi osservare come nei paesi di montagna si sono andate insrendo con armonia ville che sono passate da chalet a palazzine in stile liberty, trasferendo un tocco di città in montagna.
Nel paese di Balme e Lungo i sentieri che si addentrando nei boschi, scoprirete la «Foresta di Sherwood»: un insieme di sculture lignee su tronchi morti da parte di una scuola di scultori di Torino, который был предварительно назван dalla famosa foresta inglese.
E ancora ci sono ecomusei, realtà che uniscono le raccolte degli oggetti e dei costumi della vita quotidiana con i paesaggi e luoghi naturali.Узнайте больше о пасторах и изображениях в действующем путеводителе по альпийским горам и посетите «чинтан», «воздухозаборник» и «Бальзам» и «Коглиеры», чтобы узнать о жизни повседневного. Oppure immergervi nei boschi per raggiungere una miniera di talco dimessa, miniera Brunetta in Val Grande, e scoprire la storia dello sfruttamento dei Minerali nelle valli immedesimandovi nei minatori in miniera.
Infine se volete solamente immergervi nella natura troverete sentieri natura lungo i quali apposite bacheche illustreranno aspetti relativi фауна, флора и количественный альтро-ди-интерессант цезия.
Melitina — Wikipedia, la enciclopedia libre
La melitina es un oligopéptido que consta de 26 aminoácidos y es el main component activo de la apitoxina, el veneno de las abejas. Es un Potente activador de la fosfolipasa A2.
La secuencia de la melitina de Apis mellifera es:
Gli-Iso-Gli-Ala-Val-Leu-Lis-Val-Leu-Tre-Tre-Gli-Leu-Pro-Ala-Leu-Iso-Ser-Tri-Iso-Lis-Arg-Lis-Arg- Glu-Glu [1]
Для изоформы Apis cerana :
Gli-Iso-Gli-Ala-Val-Leu-Lis-Val-Leu-Tre-Tre-Gli-Leu-Pro-Ala-Leu-Iso-Asp-Tri-Iso-Lis-Arg-Lis-Arg- Glu-Glu [1]
Melittin es un péptido pequeño sin puente disulfuro; la parte N-terminal de la molécula es преобладающий гидрофобный y la parte C-конец es hidrófila y fuertemente básica.En el agua, forma un tetrámero pero también puede integrationrse espontáneamente en lasmbranas celulares. [2]
Mecanismos de acción [editar]
La inyección de melitina en animales y humanos causa sensación de dolor. Tiene fuertes efectos de superficie en lasmbranas celulares que causan la formación de poros en las células epiteliales y la destrucción de los glóbulos rojos. La melitina también activa las células nociceptor (рецептор долора) и través de una variedad de mecanismos. [2]
La melitina puede abrir los canales térmicos de nociceptores TRPV1 и través de los метаболиты цикла ciclooxigenasa dando como resultado la despolarización de las células nociceptores. Los efectos de formación de poros en las células provocan la liberación de citoquinas proinflamatorias. Активизируется медиальная апертура через рецептор, связанный с протеином G de los canales Potenciales del transitorio. Finalmente, la melitina regula por incremento la expresión de los canales de sodio Nav1.8 y Nav1.9 en la célula de nociceptores, lo que provoca un Potencial de acción a largo plazo y sensación de dolor. [2]
La melitina — это энзиматический ингибитор протеина quinasa C, la proteína quinasa II, зависимый от кальмодулина Ca 2+ , la quinasa de la cadena ligera de la miosina y la Na + / K + ( мембрана синаптосомальная). Bloquea las bombas de transporte tales, como Na -K -ATPase y H -K -ATPase. In vitro, la melitina aumenta la permeabilidad de lasmbranas celulares a iones, в частности Na e косвенно Ca 2 , дебидо al intercambio Na-Ca 2 .Este efecto производит cambios morfológicos y funcionales, specialmente en tejidos excitables. [3]
Actividad antimicrobiana [редактор]
La melitina posee una actividad antimicrobiana Posente. Por ejemplo, la researchación in vitro, ha demostrado que ejerce efectos ignitorios «profundos» en la Borrelia burgdorferi, la бактерии, которые причиняют энфермедад де Лайма. [4] [5] También se ha demostrado que mata las levaduras de Candida albicans, [6] y suprime influencciones por Mycoplasma hominis y Chlamydia trachomatis. [7] [8] [9]
В ходе исследования Университета Вашингтона были сделаны выводы о том, что наночастицы, транспортирующие мелитина, эффективны при уничтожении вируса VIH в окружающей среде. Las posibles aplicaciones include un gel de aplicación vaginal que tenría como objetivo la intrusión del VIH antes de la infcción y como un tratamiento intravenoso de influences existentes de VIH. [10] [11] [12]
Список литературы [редактор]
- ↑ a b Ради, Ислам; Сиддики, Имтиаз А.; Ради, Мохамад; Мухтар, Хасан (Agosto de 2017). «Мелиттин, основной пептидный компонент пчелиного яда, и его конъюгаты в терапии рака». Письма о раке 402 : 16-31. DOI: 10.1016 / j.canlet.2017.05.010 .
- ↑ a b c Джун Чен; Су-Минь Гуань и Хань Фу1,2 (2016). «Мелиттин, основное болеутоляющее вещество пчелиного яда». Бюллетень неврологии 32 (3): 265-72. PMC 5563768 . PMID 26983715 .
- ↑ Руи Ма; Равикиран Махадеваппа и Ханг Фай Квок (ноябрь 2017 г.). «Пептидная терапия на основе яда: понимание противоракового механизма». Oncotarget 8 (59): 100908-100930. ЧУП 5725072 . PMID 29246030 . DOI: 10.18632 / oncotarget.21740 .
- ↑ Lubke, L.L. & C.F. Гарон (июль 1997 г.). «Антимикробный агент мелиттин оказывает сильное ингибирующее действие in vitro на спирохеты болезни Лайма». Clin. Заразить. Дис. (английский) 25 (Дополнение 1): S48-51. PMID 9233664 . DOI: 10.1086 / 516165 .
- ↑ Антимикробная активность пчелиного яда и мелиттина против Borrelia burgdorferi // Antibiotics 2017, 6 (4), 31; DOI: 10.3390 / antibiotics6040031
- ↑ Klotz, S.A .; Н.К. Гаур; Дж. Раусео; Д.Ф. Озеро; Ю. Парк; К.С. Хам и П. Липке (ноябрь 2004 г.). «Подавление адгезии и уничтожение Candida albicans с 23-мерным пептидом (Fn / 23) с двойными противогрибковыми свойствами». Антимикробный. Агенты Chemother. (английский) 48 (11): 4337-41. PMC 525394 . PMID 15504862 . DOI: 10.1128 / AAC.48.11.4337-4341.2004 .
- ↑ Лазарев, ВН; Шкарупета М.М., Титова Г.А., Кострюкова Е.С., Акопян Т.А., Говорун В.М. (diciembre de 2005). «Влияние индуцированной экспрессии антимикробного пептида мелиттина на инфекции Chlamydia trachomatis и Mycoplasma hominis in vivo». Biochem. Биофиз.Res. Commun. (английский) 338 (2): 946-50. PMID 16246304 . DOI: 10.1016 / j.bbrc.2005.10.028 .
- ↑ Лазарев, В.Н .; Стипковиц Л., Биро Дж., Миклоди Д., Шкарупета М.М., Титова Г.А., Акопян Т.А., Говорун В.М. (mayo de 2004). «Индуцированная экспрессия антимикробного пептида мелиттина подавляет экспериментальную инфекцию, вызванную вирусом Mycoplasma gallisepticum у кур». Microbes Infect. 6 (6): 536-41. PMID 15158186 . DOI: 10.1016 / j.micinf.2004.02.006 .
- ↑ Лазарев В.Н., Парфенова Т.М., Гуларян С.К., Мисюрина О.Ю., Акопян Т.А., Говорун В.М. (февраль 2002 г.). «Индуцированная экспрессия мелиттина, антимикробного пептида, подавляет инфекцию Chlamydia trachomatis и Mycoplasma hominis в линии клеток HeLa». Внутр. J. Antimicrob. Агенты (английский) 19 (2): 133-7. PMID 11850166 . DOI: 10.1016 / S0924-8579 (01) 00479-4 .
- ↑ Пчелиный яд уничтожает ВИЧ и сохраняет окружающие клетки; Medical News Today , 11 марта 2013 г.
